En marzo de 2023, un equipo de investigación de la Universidad de Osaka anunció un logro extraordinario : la producción de óvulos viables utilizando células extraídas de ratones machos.
Basándonos en años de investigación sobre células madre y desarrollo reproductivo,1Los investigadores, dirigidos por el profesor Katsuhiko Hayashi , desarrollaron un método para inducir a las células madre masculinas a perder su cromosoma Y y duplicar el cromosoma X, convirtiéndose así en células femeninas. A partir de ahí, los investigadores tomaron las células femeninas y cultivaron óvulos a partir de ellas utilizando un elaborado protocolo que habían publicado inicialmente en 2016.
Del artículo y del revuelo mediático que le siguió surgió una pregunta: ¿cuándo estará esta tecnología disponible para la gente?
Durante casi toda la historia de la humanidad, sólo había una manera de tener un bebé. Cuando un hombre y una mujer se aman mucho… bueno, ya saben el resto. Pero para muchas personas, el método habitual de concepción no funciona. Esto es especialmente problemático para las mujeres biológicas, cuyos ovarios pierden con el tiempo la capacidad de liberar óvulos sanos. A los 40 años, la mayoría de las mujeres biológicas ya no pueden reproducirse.2Y en los últimos años, las tasas de infertilidad han aumentado junto con la edad promedio de maternidad.
El primer método para evitar algunas de las dificultades de concebir un hijo, la fecundación in vitro (FIV), apareció en 1978. Durante la FIV, se extraen óvulos de los ovarios y se mezclan con esperma. A medida que los óvulos fecundados se convierten en embriones, se transfieren al útero. Estos métodos básicos han mejorado mucho en las últimas cuatro décadas, y más de 10 millones de personas han sido concebidas mediante FIV. Alrededor de 800.000 niños nacen cada año por FIV. Sin embargo, esta tecnología todavía depende de óvulos que se forman de forma natural, lo que para muchas parejas simplemente no es una opción.3
Pero ¿y si, como sugiere el descubrimiento del equipo de Osaka en ratones, hubiera otra forma de obtener óvulos? En la última década, varios investigadores (entre los que me incluyo) han estado explorando la tentadora perspectiva de cultivar óvulos en cultivos celulares.
Este enfoque tomaría células de un adulto.4—como piel o sangre— y reprogramarlas para convertirlas en células madre pluripotentes inducidas, o iPSC. Al igual que las células madre embrionarias, las iPSC tienen la capacidad de formar cualquier célula del cuerpo adulto, incluidos los óvulos. Aunque la generación de iPSC humanas es ahora una rutina, inducir a las iPSC a formar óvulos en un proceso conocido como ovogénesis in vitro solo ha tenido éxito en células extraídas de ratones .
La producción de óvulos requiere una serie precisa de pasos de desarrollo que son difíciles de realizar correctamente in vitro o en tubos de ensayo y placas de cultivo celular. Es por esta razón que, a pesar de una prueba de concepto en ratones, la ovogénesis humana in vitro ha permanecido fuera de alcance. Incluso con células de ratón, solo alrededor del 1 al 3 por ciento de los óvulos producidos in vitro pueden formar crías viables.
Sin embargo, los investigadores están trabajando arduamente para comprender mejor los pasos necesarios para formar un óvulo sano a partir de una célula madre. Si esta tecnología pudiera reproducirse en humanos, la ovogénesis in vitro permitiría reproducirse a todo tipo de personas que antes no podían hacerlo. Pero incluso sin un método completo para la ovogénesis in vitro , resolver algunos de estos pasos abrirá la puerta a tecnologías intermedias que podrían ayudar a tratar la infertilidad. En los próximos años, las personas podrían tener hijos mediante FIV a edades mucho más avanzadas, por ejemplo, o los pacientes con cáncer podrían recuperar su fertilidad después de la quimioterapia.
El primer método para eludir algunas de las dificultades de concebir un hijo, la fertilización in vitro (FIV), llegó en 1978. Durante la FIV, los óvulos se recogen de los ovarios y se mezclan con esperma. A medida que los óvulos fertilizados se convierten en embriones, se transfieren al útero. Estos métodos básicos han mejorado mucho en las últimas cuatro décadas, y más de 10 millones de personas han sido concebidas usando FIV. Alrededor de 800.000 niños nacen de la FIV cada año. Sin embargo, esta tecnología todavía se basa en los huevos que se forman de forma natural, lo que para muchas parejas simplemente no es una opción.3
Pero, ¿y si, como sugiere el gran avance del equipo de Osaka en ratones, hubiera otra forma de conseguir huevos? En la última década, varios investigadores, incluyéndome a mí, han estado explorando la tentadora perspectiva de cultivar huevos en el cultivo celular.
Tal enfoque tomaría células de un adulto4– como la piel o la sangre – y reprogramarlos en células madre pluripotentes inducidas, o iPSC. Al igual que las células madre embrionarias, las iPSC tienen la capacidad de formar cualquier célula en el cuerpo adulto; incluidos los huevos. Aunque la generación de iPSC humanas es ahora rutinaria, persuadir a las iPSC para que formen huevos en un proceso conocido como oogénesis in vitro solo ha tenido éxito en células tomadas de ratones.
Hacer huevos requiere una serie precisa de pasos de desarrollo que son difíciles de realizar correctamente in vitro, o en tubos de ensayo y platos de cultivo celular. Es por esta razón que, a pesar de una prueba de concepto en ratones, la oogénesis in vitro humana ha permanecido fuera de alcance. Incluso con las células de ratón, solo alrededor del 1-3 por ciento de los huevos producidos in vitro pueden formar cachorros viables.
Aún así, los investigadores están trabajando duro para comprender mejor los pasos necesarios para formar un óvulo saludable a partir de una célula madre. Si esta tecnología pudiera replicarse para los humanos, la oogénesis in vitro permitiría reproducir a todo tipo de personas que antes no podían. Pero incluso sin un método completo para la oogénesis in vitro, resolver algunos de estos pasos abrirá tecnologías intermedias que podrían ayudar a tratar la infertilidad. En los próximos años, las personas podrían tener hijos de FIV a edades mucho más avanzadas, por ejemplo, o los pacientes con cáncer podrían restaurar su fertilidad después de la quimioterapia.
Cómo se forman los óvulos y los espermatozoides
En el laboratorio en el que trabajo, a la vuelta de la esquina del bullicioso Fenway Park de Boston, hay una incubadora con una placa de 96 pocillos en su interior. Cada pocillo de la placa contiene un organoide ovárico, un conjunto de células similar a un ovario en miniatura. Para crear los organoides, diferencio las células madre humanas en células germinales, o precursores de óvulos, y las agrupo junto con las células de soporte ováricas. Estos organoides son mis pequeños tesoros. Cada dos días, los alimento cuidadosamente con medio de cultivo durante los varios meses que tardan en desarrollarse y formar folículos ováricos. En este momento, estoy probando diferentes condiciones de cultivo de organoides en un esfuerzo por recrear los pasos de desarrollo necesarios para la formación de óvulos.5
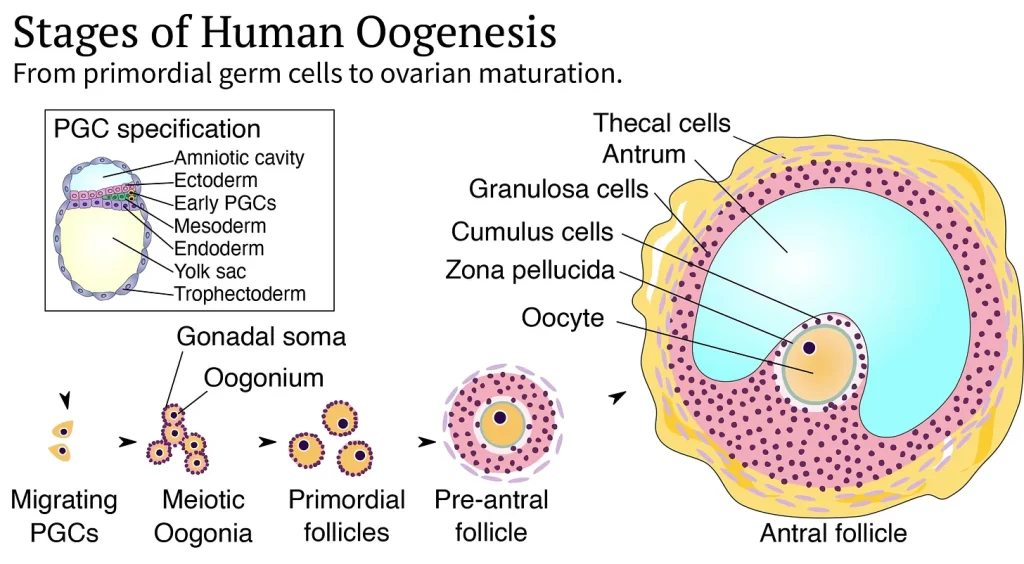
Desde la concepción hasta la pubertad, se producen varios pasos de desarrollo dentro del cuerpo humano para crear óvulos sanos. El primer paso es la especificación de las células germinales , en la que las células que luego formarán óvulos o espermatozoides (la línea germinal) se distinguen de las células que forman el resto del cuerpo. Aproximadamente dos semanas después de la concepción, una pequeña cantidad de células embrionarias reciben señales que las inducen a convertirse en células germinales primordiales (PGC), que son las progenitoras de los óvulos y los espermatozoides. Las PGC masculinas y femeninas expresan genes similares y difieren solo en sus cromosomas sexuales.
Los primeros protocolos confiables para diferenciar iPSC humanas en células similares a PGC in vitro se publicaron en 2015. Aunque este proceso se ha vuelto más eficiente con el paso de los años, la fracción de células que logran convertirse en células similares a PGC varía entre aproximadamente el 1 por ciento y el 40 por ciento, dependiendo del lote de células madre que se utilice.
El segundo paso es la asignación de la línea germinal, en la que, como se podría esperar del nombre, las células germinales primarias se comprometen por completo a formar óvulos o espermatozoides. Después de la especificación, las células germinales primarias migran a través del embrión en desarrollo hasta las gónadas, los ovarios o los testículos. Allí, se unen a las células de sostén de las gónadas, llamadas células de la granulosa en el ovario o células de Sertoli en el testículo. Las células masculinas y femeninas luego comienzan a divergir en prospermatogonias u ovogonias, respectivamente, dividiéndose desde unas pocas docenas de células hasta una población de millones.
Durante este proceso, los genomas de las células eliminan sus grupos metilo, una importante marca epigenética . Las marcas epigenéticas pueden considerarse como “notas adhesivas” químicas en los cromosomas que controlan el silenciamiento y la activación de los genes . Borrar los grupos metilo del ADN es necesario para el desarrollo normal de los óvulos y los espermatozoides.6Las células “eliminadas” entonces comienzan a expresar genes relacionados con el desarrollo reproductivo y se vuelven receptivas a las señales para iniciar la meiosis, el proceso por el cual las células se dividen y dividen su número de cromosomas a la mitad.
Aquí es donde las cosas empiezan a complicarse, ya que resulta sumamente difícil recrear las delicadas interacciones entre las células germinales y las células de sostén gonadal in vitro. Sin embargo, en los últimos años, los investigadores dirigidos por Mitinori Saitou en la Universidad de Kioto han logrado varios avances importantes.
En 2018, el equipo de Saitou informó sobre el primer método para inducir a las células humanas similares a las PGC a la etapa de ovogonias. Lo lograron tratando ovarios fetales de ratón con una mezcla de enzimas para descomponerlos en células individuales, aislando las células de soporte ováricas y mezclándolas con células humanas similares a las PGC para formar agregados, que luego se cultivaron en medios líquidos durante hasta 120 días. Este método de varios meses coincide con la duración del compromiso de la línea germinal in vivo .
Alcanzar la etapa de oogonia marcó un logro impresionante en la biología de las células germinales, porque los métodos anteriores solo llegaban hasta la etapa de PGC. Más recientemente, el mismo laboratorio publicó un método relacionado que utiliza una línea celular de ratón especializada, en lugar de ovarios fetales, para apoyar el desarrollo de células humanas similares a PGC a células similares a oogonias durante varios meses.
Sin embargo, es posible crear células similares a las ovogonias a partir de células madre humanas mucho más rápidamente. El paso más importante parece ser borrar la metilación del ADN. He estado trabajando en un método para “acelerar” la especificación y el compromiso de las células germinales en un período de sólo cinco días. Este método utiliza una sustancia química para inhibir la metilación del ADN, junto con una modificación genética para activar la expresión de factores de transcripción clave que regulan la expresión de muchos otros genes, induciendo a las células a diferenciarse a un estado similar a las ovogonias.
Después de la formación de la línea germinal, el tercer paso para formar los óvulos es la meiosis , durante la cual los cromosomas se recombinan entre sí y luego se segregan para formar gametos haploides (óvulos o espermatozoides) que contienen una copia de cada cromosoma. En los hombres, la meiosis no comienza en los testículos hasta la pubertad. La meiosis femenina comienza durante el desarrollo fetal, pero los óvulos inmaduros permanecen en pausa en la meiosis durante décadas. Por lo tanto, aunque los ovarios poseen todos los óvulos que tendrán en el momento del nacimiento, la meiosis no termina realmente hasta que el óvulo es fertilizado por el espermatozoide.
Hasta ahora, la única forma de lograr la meiosis en el laboratorio ha sido cultivar células germinales, tomadas de un ratón, junto con células de soporte ovárica fetal. A medida que las células crecen, las señales químicas activan la meiosis en las células germinales. Si bien es prometedora porque demuestra que la meiosis puede ocurrir fuera del cuerpo, hasta donde yo sé, esta técnica no ha tenido éxito en las células humanas.
En nuestro laboratorio de Fenway, recientemente desarrollé un método para iniciar directamente la meiosis en células humanas . Primero, los grupos metilo unidos al ADN se borran artificialmente utilizando un inhibidor químico para imitar el borrado que ocurre durante la asignación de la línea germinal. Luego, induzco las vías de señalización involucradas en la meiosis. Las células diseñadas de esta manera solo progresan parcialmente a través de la meiosis, pero estoy refinando el método constantemente. Si logro completar la meiosis con éxito, sería un gran paso hacia la producción de óvulos a partir de células humanas adultas.
La cuarta etapa para producir óvulos es el crecimiento de las células precursoras del óvulo hasta que alcanzan un gran tamaño . Con un diámetro de aproximadamente 0,1 mm, el óvulo es la célula humana más grande. Contiene reservas de proteínas y ARN que son utilizadas por el embrión en desarrollo. Los óvulos crecen dentro de los folículos ováricos, donde las células de la granulosa los llenan de nutrientes. Durante este proceso, el folículo también crece y alcanza unos pocos centímetros de diámetro.
Este paso en el desarrollo de los óvulos aún no se ha logrado utilizando células madre humanas. Sin embargo, las muestras de biopsia de folículos ováricos se pueden transferir a un cultivo celular. E incluso cuando se extraen del cuerpo, los folículos ováricos continúan produciendo óvulos maduros. Pero este proceso es ineficiente y, a fecha de abril de 2024, todavía no se ha producido ningún nacimiento vivo . Aun así, los métodos para cultivar folículos en el laboratorio son una opción prometedora para preservar la fertilidad de las pacientes con cáncer a las que se les extirpan los ovarios. Estos métodos también se podrían aplicar al tejido ovárico derivado de células madre humanas una vez que los científicos descubran cómo llegar a la etapa de folículo primario, donde los óvulos han completado la primera etapa de la meiosis pero aún no han crecido lo suficiente como para formar embriones.
Curiosamente, es posible saltarse la meiosis y crear células grandes similares a óvulos directamente a partir de células madre de ratón. Pero las células creadas de esta manera no suelen tener la cantidad correcta de cromosomas y, por lo tanto, los óvulos no se desarrollan normalmente después de la fertilización.
El paso final para el desarrollo del óvulo es establecer una epigenética adecuada . A medida que se desarrolla un embrión, estas marcas epigenéticas podrían, por ejemplo, controlar los genes de señalización que le indican a la placenta cuánto crecer. Después de ser borradas durante la asignación de la línea germinal, las marcas epigenéticas deben reescribirse adecuadamente durante el desarrollo del óvulo. Pero incluso en ratones, la única especie en la que la ovogénesis in vitro ha tenido éxito, entre el 97 y el 99 por ciento de los óvulos producidos no pueden dar lugar a crías vivas. Una epigenética deficiente es una de las principales razones de esta baja eficiencia.
En teoría, un método de ovogénesis in vitro que imitara exactamente el desarrollo ovárico natural sería capaz de lograr la epigenética adecuada sin intervención adicional. Pero imitar el desarrollo ovárico humano natural llevaría, como mínimo, varios años, ¡y el proceso natural de ovogénesis humana ni siquiera es particularmente eficiente! Incluso en los años de máxima fertilidad de una mujer, la probabilidad de que uno de sus óvulos se desarrolle adecuadamente después de la fertilización es de solo un 30 por ciento.
Parte de esta baja tasa de éxito se debe a errores durante la meiosis, aunque una epigenética incorrecta de los óvulos también explica el fracaso de muchos embriones en desarrollarse adecuadamente. Por ejemplo, un estudio reciente sobre embriones humanos encontró diferencias en la metilación del ADN derivado de óvulos entre embriones sanos y embriones que no activaron genes importantes para el desarrollo.
Afortunadamente, la ingeniería epigenética tiene el potencial de hacer que la ovogénesis in vitro sea más rápida y eficiente. Los científicos han estado desarrollando métodos para borrar y escribir con precisión las marcas epigenéticas, incluidas la metilación del ADN y las modificaciones de las histonas, mediante el uso de la tecnología CRISPR para guiar las enzimas modificadoras epigenéticas a sitios específicos en el genoma.
Las herramientas CRISPR epigenéticas se dirigen a una secuencia de ADN particular utilizando una molécula de ARN guía. Pero en lugar de cortar el ADN, como lo haría normalmente CRISPR-Cas9, los editores epigenéticos agregan o eliminan etiquetas químicas. Al agregar y eliminar la metilación en sitios reguladores importantes en el genoma, los científicos pudieron crear ratones con ambos conjuntos de cromosomas originados a partir de un óvulo formado naturalmente, lo que generalmente es imposible debido a la impronta epigenética . Aunque la ingeniería a gran escala del epigenoma sigue siendo difícil, los avances recientes en la edición CRISPR multiplex , que podría adaptarse para la edición epigenética, me hacen ser optimista de que este paso final en el desarrollo del óvulo podría recrearse en el laboratorio.
También se podrían utilizar tecnologías similares para producir esperma a partir de células madre. La infertilidad afecta aproximadamente al 7 por ciento de los hombres , y alrededor del 1 por ciento de ellos carecen por completo de esperma . Pero en comparación con la ovogénesis, la espermatogénesis in vitro ha recibido mucha menos atención por dos razones.
En primer lugar, los espermatozoides están mucho más disponibles que los óvulos. Aunque la producción de espermatozoides disminuye con la edad, los hombres mayores aún pueden reproducirse de forma natural con parejas más jóvenes o con donantes de óvulos.7En segundo lugar, la espermatogénesis es más complicada que la ovogénesis. Mientras que los folículos ováricos son estructuras pequeñas y autónomas, los espermatozoides se producen en el interior de los túbulos seminíferos. Hay aproximadamente 600 metros de estos finos tubos, cada uno de un cuarto del diámetro de la pasta de cabello de ángel, enrollados dentro de cada testículo de cada hombre.
En el laboratorio, los folículos ováricos se pueden crear simplemente mezclando células de sostén ováricas y células germinales. Pero esto no funciona con los organoides testiculares porque un agregado aleatorio de células de sostén y células germinales carece de la organización de largo alcance necesaria para formar túbulos seminíferos. Sería como hervir un trozo de masa de pan en salsa de tomate y esperar que se convierta en espaguetis. Por lo tanto, para imitar el desarrollo natural de los espermatozoides fuera del cuerpo se necesitarán avances significativos en la tecnología de los organoides.
Sin embargo, la espermatogénesis artificial puede ser posible dentro del cuerpo humano. A diferencia del ovario, el testículo adulto contiene una población de células madre que se autorenueva, llamadas células madre espermatogoniales (SSCs), que son las precursoras de los espermatozoides. Debido a que la quimioterapia a menudo destruye las SSCs, los investigadores del cáncer han estado explorando la posibilidad de preservar las SSCs y trasplantarlas nuevamente a un paciente después del tratamiento. Un equipo de investigadores con base principalmente en el MD Anderson Cancer Center en Texas demostró recientemente este procedimiento en monos rhesus, restaurando con éxito su fertilidad después de la irradiación.
Si las SSC humanas pueden derivarse de las iPSC, entonces esas células podrían trasplantarse al testículo de un paciente.8Aunque este método requeriría un testículo preexistente, sería útil para tratar muchos casos de infertilidad masculina. Por ejemplo, la azoospermia no obstructiva, una enfermedad que afecta al uno por ciento de los hombres, hace que los testículos no puedan producir esperma, a menudo debido a mutaciones que hacen que las células madre espermáticas estén ausentes o defectuosas. El tratamiento para la azoospermia podría implicar la edición de células madre espermáticas individuales derivadas del paciente para corregir las mutaciones, luego diferenciar las células madre espermáticas individuales a células madre espermáticas y trasplantarlas nuevamente al paciente.
Llegando a la clínica
El primer anuncio de un óvulo humano cultivado a partir de una célula madre puede tardar unos pocos años. Sin embargo, es poco probable que los métodos iniciales para lograrlo den como resultado óvulos de alta calidad adecuados para generar bebés sanos. Si bien la cantidad puede tener una cualidad propia cuando se trata de cultivar óvulos en un contexto de investigación, esto definitivamente no es cierto para la reproducción humana.
Recordemos que las primeras demostraciones de ovogénesis in vitro a partir de células de ratón dieron como resultado solo entre el 1 y el 3 por ciento de los óvulos capaces de formar crías viables. Los óvulos cultivados en laboratorio suelen presentar problemas epigenéticos y, dado que las pruebas epigenéticas no destructivas de los embriones son difíciles, el uso de óvulos cultivados in vitro para la reproducción plantea actualmente un riesgo inaceptable de producir un bebé que sufra un trastorno epigenético, como el síndrome de Angelman.9
Antes de que la ovogénesis in vitro completa sea factible, probablemente veamos primero la tecnología de reproducción asistida ayudando a que las etapas finales del desarrollo del óvulo “lleguen a la meta”.
Un problema común durante la FIV es que muchos óvulos recolectados no están completamente maduros y, por lo tanto, no son aptos para la fertilización. Gameto, una empresa emergente con sede en la ciudad de Nueva York, ha comenzado recientemente ensayos clínicos en los que los óvulos inmaduros recolectados durante la FIV se cultivan con células de apoyo ovárico derivadas de células madre humanas . Este proceso tiene como objetivo ayudar a que los óvulos inmaduros alcancen una etapa más madura. Aunque esta tecnología solo puede aumentar la cantidad de embriones que se pueden producir por ciclo de FIV en aproximadamente un 25% ,10Este sigue siendo un beneficio importante para las parejas que intentan concebir.
La próxima tecnología que se utilizará en la práctica clínica probablemente consistirá en cultivar óvulos maduros a partir de precursores anteriores encontrados en muestras de biopsias de ovario, un proceso conocido como crecimiento y maduración de folículos in vitro . Llevado al extremo, esto se parecería a la visión de Aldous Huxley en Un mundo feliz , en la que se utilizan muestras de tejido ovárico para cultivar lotes de óvulos por miles.11De manera menos especulativa, esta tecnología podría utilizarse para restaurar la fertilidad en mujeres biológicas que han perdido la mayoría, pero no todos, de sus folículos ováricos sanos.
Varias pacientes de cáncer ya han podido recuperar la función ovárica después de la quimioterapia, e incluso tener bebés sanos, trasplantando nuevamente en sus ovarios una muestra de tejido ovárico congelado extraído antes de la quimioterapia . Esto demuestra que los folículos ováricos se pueden conservar fuera del cuerpo y, actualmente, el cultivo in vitro de tejido ovárico está casi listo para su uso clínico. El principal obstáculo parece ser simplemente el reclutamiento de suficientes pacientes para los ensayos clínicos. Hasta ahora, esta tecnología se ha desarrollado centrándose en pacientes de cáncer, no en mujeres sanas, lo que hace que los ensayos sean mucho más difíciles de realizar.
Pero para muchas personas, empezar con un trozo de tejido ovárico no es una opción, y esto me lleva de nuevo a la ovogénesis in vitro y a las barreras existentes para su desarrollo.
Cuando en 2016 se anunció el primer nacimiento de ratones a partir de óvulos cultivados en laboratorio, investigadores de todo el mundo comenzaron a trabajar con ahínco para trasladar el método a los seres humanos. Pero esto ha resultado complicado por múltiples razones. El protocolo original con ratones utilizaba células ováricas fetales para sustentar las células germinales derivadas de células madre, pero obtener tejido ovárico fetal humano es poco práctico desde el punto de vista ético y técnico. El tejido fetal de ratón puede sustentar el desarrollo de ovogonias humanas hasta cierto punto, pero no es adecuado para la ovogénesis completa.
Las células humanas y de ratón también presentan varias diferencias en la regulación genética. Las condiciones de cultivo optimizadas para células de ratón no funcionan bien para células humanas.
Por último, el desarrollo humano es intrínsecamente mucho más lento que el de los ratones. A partir del embrión, el ovario humano tarda aproximadamente 15 años en desarrollarse por completo, en comparación con las 9 semanas que tarda el ovario del ratón. El desarrollo humano se puede acelerar considerablemente en cultivos celulares, pero aun así, los experimentos suelen tardar varios meses, lo que dificulta su rápida repetición.
No obstante, el ritmo de los avances en este campo, especialmente por parte de los investigadores de la Universidad de Kioto, me ha hecho albergar la esperanza de que los primeros óvulos humanos cultivados in vitro estén a sólo uno o dos años de distancia. Varias empresas emergentes, en particular Conception , Ivy Natal, Dioseve y Vitra Labs , también han estado trabajando arduamente en este problema y pueden estar cerca de resolverlo . Pero esto solo marcará el final del principio.
A juzgar por los resultados obtenidos con ratones , la calidad de los óvulos obtenidos in vitro en células humanas será inicialmente muy baja, probablemente debido a marcas epigenéticas errantes. Es posible que sea posible transferir cromosomas de un óvulo de baja calidad cultivado in vitro a un óvulo de donante de mayor calidad.12Pero esto supondría una mayor exigencia para el ya limitado suministro de óvulos donados y no resolvería por completo los problemas epigenéticos. Se necesitarán ensayos de seguridad extensos, incluido el nacimiento de primates no humanos sanos, antes de que puedan comenzar los primeros ensayos clínicos en humanos.
En un futuro más lejano, los óvulos cultivados in vitro serán de mayor calidad que los óvulos naturales, porque las condiciones de cultivo en un laboratorio se pueden controlar y optimizar hasta un grado que no es posible en los ovarios naturales. En el corto plazo, ocurrirá lo contrario: los bebés nacidos a partir de óvulos cultivados in vitro probablemente se enfrentarán a un mayor riesgo de trastornos del desarrollo. Esto plantea una cuestión ética perenne y muy debatida: ¿cuánto riesgo es aceptable?
Es claramente poco ético crear un bebé que experimentará principalmente sufrimiento durante su vida. Si el 25 por ciento de los bebés nacidos de óvulos cultivados in vitro experimentan muertes dolorosas, seguramente la mayoría de la gente estaría horrorizada. Aun así, no es ilegal que dos portadores de la enfermedad de Tay-Sachs se reproduzcan de forma natural, a pesar de que sus bebés se enfrentarían a probabilidades similares.
Después de afrontar las consecuencias de la eugenesia coercitiva en el último siglo, la sociedad ha decidido con razón que es inaceptable prohibir a las personas reproducirse. Por lo tanto, si personas infértiles quieren tener hijos biológicos mediante una tecnología riesgosa, ¿se les debe negar esa posibilidad?
Esta cuestión recaerá en la FDA y en agencias reguladoras médicas similares en otros países.13La FDA ha adoptado un enfoque regulatorio relativamente indulgente hacia las tecnologías reproductivas , pero los políticos estadounidenses han ordenado anteriormente que la FDA prohíba los ensayos de tecnologías reproductivas prometedoras, incluida una tecnología llamada terapia de reemplazo mitocondrial.14que se utiliza para crear embriones con cromosomas del espermatozoide de un hombre y del óvulo de una mujer, junto con mitocondrias del óvulo de una segunda mujer.
La terapia de reemplazo mitocondrial se ha utilizado con éxito en otros países en casos de mujeres con trastornos mitocondriales. A medida que las nuevas tecnologías se vuelven más apreciadas, su regulación puede convertirse en un tema político candente. Después de todo, incluso la FIV, aunque está bien establecida, está siendo atacada en estos días en los Estados Unidos.
Perspectivas costosas
Si la tecnología de la ovogénesis surge incluso en un contexto de polémica política y estricta regulación, queda la pregunta de quién podrá acceder a ella y para qué exactamente será útil. Aunque los demógrafos llevan mucho tiempo preocupados por la disminución de las tasas de fertilidad , es poco probable que la ovogénesis in vitro revierta esta tendencia.15Las decisiones reproductivas se basan principalmente en factores sociales y económicos, como el coste de la vivienda y el cuidado de los niños. Aunque aspiro a que la ovogénesis in vitro sea accesible para todos, independientemente de su nivel económico, es probable que resulte bastante cara a corto plazo.
En Estados Unidos, la FIV cuesta entre 10.000 y 20.000 dólares por ciclo y su realización es considerablemente menos complicada desde el punto de vista técnico que la ovogénesis in vitro . Una empresa llamada Viagen Pets cobra 50.000 dólares por clonar un gato, en un proceso que no sólo es mucho más sencillo que cultivar un óvulo, sino que también tiene una menor demanda. La terapia CAR-T contra el cáncer, una terapia personalizada que implica el cultivo y la ingeniería de las células de un paciente, cuesta entre 370.000 y 530.000 dólares en Estados Unidos , aunque el precio es de sólo 30.000 a 40.000 dólares en la India.
Teniendo en cuenta los costos de estos procedimientos, espero que la primera terapia de ovogénesis in vitro disponible comercialmente cueste alrededor de 150.000 a 250.000 dólares, sin incluir los costos adicionales para fertilizar e implantar los óvulos después de que se cultiven in vitro.
En lugar de provocar un segundo baby boom, las nuevas tecnologías reproductivas ampliarán principalmente el número de personas que pueden tener hijos biológicos. En primer lugar, el cultivo de óvulos a partir de muestras de biopsia de ovario permitirá a las mujeres obtener óvulos incluso cuando su reserva ovárica esté disminuida. Esto podría extender la edad de fertilidad hasta alrededor de los 45 años.
Además, esta tecnología permitiría a las mujeres más jóvenes generar una mayor cantidad de óvulos a partir de muestras de tejido. Al permitirles congelar más óvulos, tendrían más posibilidades de tener bebés en el futuro.
Con la ovogénesis in vitro , las posibilidades de reproducción se ampliarán aún más. Las mujeres mayores, las mujeres trans y los hombres podrían cultivar óvulos utilizando su material genético, aunque esto será más difícil para los varones biológicos. Y como los padres que actualmente seleccionan embriones para implantar en función de rasgos poligénicos positivos (como un bajo riesgo de cáncer) tienen un número limitado de embriones para elegir, el cultivo de grandes cantidades de óvulos también aumentaría moderadamente las posibles ganancias de la selección de embriones.16
Con el tiempo, las nuevas tecnologías reproductivas transformarán lenta pero sostenidamente todo, desde la demografía hasta la forma en que pensamos sobre las opciones. Los adultos del mañana son los bebés de hoy y, dentro de veinte años, la pregunta de “¿de dónde vienen los bebés?” podría tener una amplia variedad de respuestas.
En mi vida espero ver un mundo donde cualquiera que lo desee pueda tener hijos biológicos.
***
1 Como escribió el revisor 1 : “La mayoría de los enfoques descritos no son tan novedosos desde una perspectiva tecnológica… Sin embargo, sumar estos enfoques para lograr la producción de óvulos a partir de ratones machos es claramente un logro importante”.
2 Incluso con FIV , la probabilidad es sólo del 44 por ciento después de tres ciclos.
3 Esto incluye parejas de dos varones biológicos o parejas en las que una mujer es infértil debido a la falta de óvulos sanos.
4 Las células de la piel y las células sanguíneas son los tipos de células a los que es más fácil acceder, pero por motivos de seguridad, sería mejor elegir un tipo de célula inicial con una baja tasa de mutaciones, como una célula madre de la médula ósea.
5 Encontrar las condiciones adecuadas es bastante complicado. Una vez, accidentalmente, hice que mis células produjeran tejido cardíaco en lugar de tejido ovárico, ¡y el organoide comenzó a latir!
6 Aparte de la impronta epigenética , varios genes importantes para el desarrollo de óvulos y espermatozoides solo se expresarán si el ADN de sus promotores no está metilado.
7 Es famoso el hecho de que el presidente estadounidense John Tyler (nacido en 1790) todavía tiene un nieto vivo , debido a que los hombres de esa familia tuvieron hijos en edad avanzada.
8 Algunos artículos publicados en la década de 2010 afirmaron haber obtenido células madre SSC humanas a partir de células madre pluripotentes inducidas (iPSC), aunque no de manera convincente.
9 La epigenética varía considerablemente entre el trofectodermo, que forma la placenta, y la masa celular interna, que forma el bebé propiamente dicho. Las biopsias del trofectodermo, que se utilizan habitualmente para las pruebas genéticas, son mucho menos útiles en este caso, porque no toman muestras de la masa celular interna y, por lo tanto, es posible que no detecten anomalías epigenéticas en dicha masa. Sin embargo, tomar muestras de la masa celular interna dañaría al embrión, por lo que no hay una manera sencilla de solucionar este problema.
10 Normalmente entre el 15 y el 25% de los óvulos recuperados para la FIV son inmaduros (estadio GV), pero en los protocolos de recolección de óvulos que utilizan dosis hormonales más bajas para minimizar los efectos secundarios, este porcentaje puede ser mucho mayor.
11 Conocida como “La técnica de Podsnap”, pág. 6.
12 Esto es similar a lo que se hace actualmente en la terapia de reemplazo mitocondrial, en la que los cromosomas de un óvulo se transfieren a otro.
13 Según el Título 21 CFR 884 , la FDA regula la tecnología de reproducción asistida según las regulaciones para dispositivos médicos, que no son tan estrictas como las regulaciones para medicamentos.
14 El sitio web de la FDA que anuncia la prohibición también dice que la terapia de reemplazo mitocondrial “introduce una modificación genética”, pero esto es totalmente incorrecto. Ni las mitocondrias ni los cromosomas se editan ni modifican. En cambio, los cromosomas de un óvulo con mitocondrias no saludables simplemente se transfieren a un óvulo que contiene mitocondrias saludables.
15 Se podrían crear úteros artificiales, pero son órdenes de magnitud más difíciles de lograr, por razones que se abordarán en un próximo artículo en Asimov Press .
16 La ganancia esperada es proporcional a la raíz cuadrada del logaritmo del número de embriones, por lo que sería necesario seleccionar entre 10.000 embriones para lograr el doble de ganancia que si se seleccionara entre 10 embriones. Sin embargo, realizar múltiples rondas de gametogénesis in vitro permitiría múltiples etapas de selección, lo que generaría ganancias mayores.
Publicado originalmente en Asimov Press: https://www.asimov.press/p/eggs
Metacelsus es un estudiante de doctorado que investiga la biología sintética, las células madre y el desarrollo reproductivo. También escribe el blog De Novo .
Cita: Metacelsus. «Fabricación de óvulos sin ovarios». Asimov Press (2024). DOI: https://doi.org/10.62211/41pr-87er